Aplastische Anämie
Im allgemeinen Sprachgebrauch wird eine Anämie als Blutarmut bezeichnet. Bei der aplastischen Anämie ist dies durch das Fehlen oder eine deutliche Verringerung von blutbildendem Gewebe im Knochenmark bedingt. Dies führt dazu, dass die Anzahl der Blutzellen aus allen drei Zellreihen vermindert ist.
Die hauptsächliche Neubildung der Blutzellen findet im Knochenmark statt. Der aplastischen Anämie liegt immer eine Schädigung des Knochenmarkes zugrunde, bei der die Bildung von Zellen aller drei Zelllinien herabgesetzt ist. Dieser Mangel der roten Blutkörperchen (Erythrozyten), der weißen Blutkörperchen (Leukozyten) sowie der Blutplättchen (Thrombozyten) wird in Fachkreisen als Panzytopenie bezeichnet.
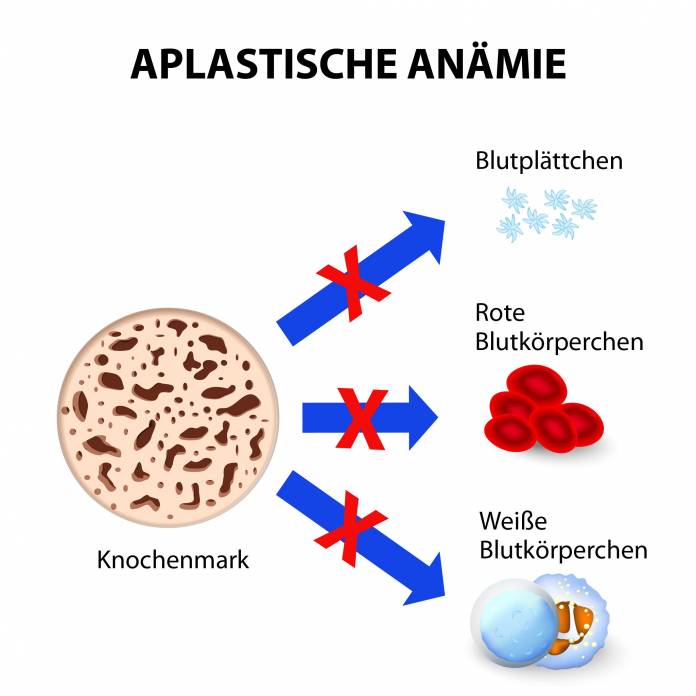
Diese Form der Blutarmut, die manchmal auch als aplastisches Syndrom bezeichnet wird, kann angeboren sein oder im Laufe des Lebens erworben werden. Das Blut ist für den Transport von Sauerstoff und Nährstoffen, aber auch für weitere Aufgaben wie der Immunabwehr von wesentlicher Bedeutung. Daher führt eine Störung der Blutbildung zu negativen Auswirkungen im ganzen menschlichen Organismus.
Ein wichtiger Pfeiler der Diagnostik und Therapie bei aplastischer Anämie ist die Begutachtung des Knochenmarks. Eine Heilung kann bisher nur durch eine Stammzelltransplantation erreicht werden. Ohne Behandlung führt die aplastische Anämie in vielen Fällen zum Tode.
Häufigkeit (Epidemiologie)
Aufgrund der geringen Zahl von Neuerkrankungen pro Jahr (Inzidenz: 2 von 1.000.000 Einwohnern) kann man in Mitteleuropa von einer seltenen Erkrankung sprechen. Kinder bis zu einem Alter von 16 Jahren sind mit 25 Neuerkrankungen pro Jahr auf 1.000.000 Kinder überdurchschnittlich häufig betroffen. Ein zweiter Höhepunkt kann bei Erwachsenen über 60 Jahren festgestellt werden.
Ursachen
Als verantwortlicher Mechanismus für die Schädigung des Knochenmarks werden überwiegend fehlgesteuerte Abwehrreaktionen des Körpers festgemacht. Diesen Autoimmunreaktionen können angeborene als auch erworbene Ursachen zugrunde liegen.
Ohne erkennbare Ursachen (idiopathisch)
Ist die Ursache für die aplastische Anämie zum gegebenen Zeitpunkt nicht bekannt, spricht man von einer idiopathischen aplastischen Anämie. Dies trifft auf über 80 Prozent aller Patienten zu. Warum sich das Immunsystem gegen die körpereigenen blutbildenden Zellen richtet, ist bisher nicht ausreichend erforscht.
Angeborene (primäre) Ursachen
Erblich bedingte aplastische Anämien treten vielfach schon im Kindesalter in Erscheinung. Offenkundig sind hier ein gehäuftes familiäres Auftreten sowie vielfache körperliche Missbildungen. Als Verursacher sind verschiedene genetische Schäden (Brüche an den Chromosomen oder Veränderungen der Erbgut-Zusammensetzung) möglich.
Fanconi-Anämie
Der Schweizer Arzt Guido Fanconi erkannte 1927 den Zusammenhang zwischen einer Anämie und Missbildungen. Den betroffenen Kindern fehlt die Möglichkeit des Organismus, fehlerhaft zusammengefügte Erbinformationen zu reparieren. Die Folge sind Fehlbildungen des Gehirns, der oberen Extremitäten (Arme und Hände), der Haut und der Nieren. Im Alter von fünf bis zehn Jahren tritt das Krankheitsbild in seiner ganzen Ausprägung zutage. Durch eine vorgeburtliche (pränatale) Diagnostik kann die Erkrankung ab der 9. bis zur 16. Schwangerschaftswoche erkannt werden.
Heute beträgt das durchschnittlich erreichte Lebensalter etwa 24 Jahre. Eine hohe Sterblichkeitsrate bedingt eine frühzeitige Therapie mittels einer Stammzelltransplantation.
Telomeropathien (Dyskeratosis congenita)
Telomere muss man sich wie Schutzkappen an den Endigungen der Chromosomen (Erbanlagen) vorstellen. Im Verlauf der natürlichen Zellteilung schmilzt diese Schutzkappe. Aufgrund einer Veränderung des Erbgutes kann es zu einer Verringerung der Schutzfunktion durch die Telomere kommen. Die Folge ist eine schnellere Alterung der blutbildenden Zellen bis hin zum kompletten Ausfall.
Klinisch fällt diese Form der aplastischen Anämie durch typische Veränderungen der Haut und der Lunge und durch einen Umbau der Leber (Leberfibrose) auf. Die Diagnosestellung hat hinsichtlich der Therapie eine besondere Wichtigkeit. Eine Behandlung, welche auf der Unterdrückung des Immunsystems basiert, spricht bei diesen Patienten nicht an. Ebenso kommt eine Stammzelltransplantation nur bedingt infrage, da sich durch Komplikationen (Lungenfibrose) die Lebenserwartung deutlich reduzieren kann.
Blackfan-Diamond-Anämie
Hier handelt es sich ebenso um eine spezielle erbliche Form einer aplastischen Anämie. Betroffen sind indes ausschließlich die roten Blutkörperchen, sodass man von einer Erythrozyten-Aplasie spricht. Die Blackfan-Diamond-Anämie tritt üblicherweise in den ersten Lebensmonaten auf. Sie ist gekennzeichnet durch Fehlbildungen, beispielsweise an den Genitalien, sowie Störungen beim Schluckreflex.
Erworbene/sekundäre Ursachen
Gleichfalls können äußere Faktoren das Knochenmark nachhaltig schädigen und zu einer aplastischen Anämie führen. Chemische Substanzen und Infekte zählen zu den häufigsten Gründen einer sekundären aplastischen Anämie. Eine exakte ursächliche Zuordnung ist jedoch nicht in jedem Fall möglich.
Medikamente als Auslöser
Eine Vielzahl unterschiedlich wirkender Medikamente scheint in der Lage zu sein, das Knochenmark zu schädigen. Eine besondere Rolle kommt dem Chloramphenicol zu. Dieses Antibiotikum gilt als besonders schädlich für das blutbildende Gewebe und löst häufig eine aplastische Anämie aus. Es wird allerdings angenommen, dass eine erbliche Vorbelastung mancher Patienten beim Abbau des Chloramphenicol vorhanden sein muss, damit es zu einer Schädigung des Knochenmarks kommen kann.
Quinacrin wird in der Literatur noch als knochenmarkschädigende Substanz erwähnt. Das als Malaria-Mittel bekannte Medikament ist mittlerweile weitestgehend vom Markt genommen. Dagegen stehen einige entzündungshemmende Medikamente (Gold, Phenylbutazon, Diclofenac), Antiepileptika (Phenytoin, Carbamazepin) sowie Schilddrüsenmedikamente (Carbimazol, Thiouracil) im Verdacht, eine aplastische Anämie auszulösen. Mittel, welche bei Diabetes mellitus zum Einsatz kommen (Tolbutamid), sowie verschiedene weitere Antibiotika (Sulfonamide, Cotrimoxazol) sind ebenfalls in der Lage, das Knochenmark zu schädigen.
Medikamente mit dieser möglichen Nebenwirkung sollten ausschließlich unter ärztlicher Aufsicht und streng nach Anweisung eingenommen werden. Eine laufende Kontrolle des Blutbildes ist bei längerer Einnahme erforderlich.
Infektionskrankheiten als Ursache
Erkrankungen, welche durch Viren hervorgerufen werden, haben hinsichtlich der Entstehung einer aplastischen Anämie eine nicht unerhebliche Bedeutung erlangt. So konnte bei knapp fünf Prozent der an aplastischer Anämie erkrankten Menschen im Vorfeld eine Hepatitis (Leberentzündung) nachgewiesen werden. Hingegen kommt keiner der bislang gängigen Hepatitis-Viren als Auslöser infrage.
Als akute transitorische Form der Erythrozyten-Aplasie wird eine vorübergehende (transitorische) Verminderung der Blutbildung beschrieben. Im Verdacht stehen hier insbesondere Parvoviren, welche als Erreger der Ringelröteln gelten.
Berufsbedingte Erkrankungen
Die Handhabung verschiedener Chemikalien kann dosisabhängig und entsprechend der Dauer des Kontaktes zu einer aplastischen Anämie führen. Wird eine solche Substanz als Auslöser identifiziert, kann dies zur Anerkennung der aplastischen Anämie als Berufserkrankung beitragen.
Benzol: Unter den organischen Kohlenwasserstoffen zählt insbesondere das Benzol zu den bekannten Knochenmarksgiften. Arbeitnehmer, welche bei der Herstellung oder im Vertrieb mit Benzin beschäftigt sind, unterliegen einem erhöhten Risiko, an einer aplastischen Anämie zu erkranken.
Haarfärbemittel: Besonders in der Kritik stehen aromatische Amine und sollten nach Möglichkeit vermieden werden, auch wenn ein Zusammenhang nicht erwiesen ist.
Insektizide: Vergiftungen bei der Anwendung von Insektiziden durch chlorierte Kohlenwasserstoffe sind heute in den Hintergrund gedrängt. Bei langfristigem Kontakt und hoher Dosierung, wie sie in der Industrie möglich sind, müssen entsprechende Arbeitsschutzvorschriften eingehalten werden.
Ionisierende Strahlen (Radioaktivität)
Schädigungen des blutbildenden Systems sind eines der wesentlichen Probleme beim Kontakt mit ionisierenden Strahlen. Akute und hohe Strahlendosen führen meist zum Tod, während eine niedrige, über Jahre einwirkende Dosis auch in späten Jahren zu einer Aplasie führen können.
Selten beschriebene Auslöser
Sehr vereinzelt werden aplastische Anämien bei entzündlichen Geschehen der Bauchspeicheldrüse oder bestimmten Tuberkulose-Formen beobachtet. Schwangerschaften sind auch als möglicher Auslöser beschrieben worden. Indes wurde mehrfach ein Zusammenhang zwischen dem Auftreten einer paroxysmalen nächtlichen Hämoglobinurie (einer Erkrankung der blutbildenden Stammzellen) und einer aplastischen Anämie festgestellt.
Blackfan-Diamond-Anämie
Diese chronische Erythrozyten-Aplasie kann neben der erblichen Variante auch erworben werden. Da der zugrundeliegende Auslöser häufig nicht gefunden werden kann, muss die Blackfan-Diamond-Anämie gegebenenfalls als idiopathisch eingeordnet werden. Diskutiert wird auch ein Zusammenhang mit Autoimmunerkrankungen (Erkrankungen mit Immunreaktion gegen körpereigenes Gewebe), beispielsweise mit dem Lupus erythematodes.
Symptome
Klinische/körperliche Symptome
Die aplastische Anämie zeichnet sich durch die Beteiligung sowohl der roten als auch der weißen Blutkörperchen und auch der Blutplättchen aus. Typische Zeichen einer Blutarmut wie blasse Haut und Abgeschlagenheit, eine untypische Häufung von Infektionen sowie eine vermehrte Blutungsneigung sind daher meist der erste Anlass, den Hausarzt aufzusuchen. Angeborene aplastische Anämien neigen dazu, sich schleichend einzustellen. Insbesondere bei Kindern mit erblich bedingter aplastischer Anämie kann die Blutarmut über Monate unbemerkt verlaufen.
Eine Vergrößerung der Lymphknoten sowie der Leber oder Milz werden nicht als zwingendes Anzeichen für eine aplastische Anämie angesehen.
Symptome bei einem Mangel an Blutplättchen (Thrombozytopenie)
Leitsymptom der aplastischen Anämie ist vor allen anderen Symptomen eine erhebliche Blutungsneigung. Diese macht sich vor allem an der Haut durch blaue Flecken (Hämatome) und punktförmige Einblutungen unter der Oberfläche (Petechien) bemerkbar. Auch über Nasenbluten und Zahnfleischbluten berichten die betroffenen Patienten. Da der Blutungsneigung eine Verminderung der Blutplättchen (der Thrombozyten) zugrunde liegt, kann es auch zu spontanen, schwer zu stillenden Blutungen kommen. Unbehandelt finden sich im späteren Krankheitsverlauf dann schwere Blutungen der inneren Organe und des Gehirns.
Symptome bei einem Mangel an roten Blutzellen (Blutarmut, Anämie)
Die Hauptaufgabe der roten Blutkörperchen ist der Transport von Sauerstoff zu den Zellen. Sowohl die Anzahl der Erythrozyten (der roten Blutkörperchen) als auch der Blutfarbstoff Hämoglobin werden als diagnostische Marker herangezogen. Sinkt der Wert des Hämoglobins unter die Grenze des normalen Bereiches, welche je nach Geschlecht und Alter etwas variiert, spricht man von einer Anämie. Bei kleinen Kindern mit einem langsamen Fortschreiten der Erkrankung wird bei der Erstdiagnostik nicht selten ein Hämoglobinwert von 4g/dl gemessen.
Eine im Krankheitsverlauf zunehmende Blässe, Erschöpfungszustände, Luftnot, Kopfschmerzen und in einigen Fällen Sehstörungen sind die typischen Anämiezeichen.
Symptome bei einem Mangel an weißen Blutzellen (Leukozytopenie)
Ein Mangel an weißen Blutkörperchen (den Leukozyten) entwickelt sich in den meisten Fällen erst in einem späteren Stadium der aplastischen Anämie. Aufgrund der sich daraus ergebenden Abwehrschwäche sind Infektionen durch Erreger wie Pilze, Bakterien und Viren häufige Komplikationen. Vielfach beobachtet werden Krankheitsbilder wie Infektionen im Mund- und Rachenraum (zum Beispiel Gingivitis/Zahnfleischentzündung) oder Phlegmone (eine bakterielle Gewebeentzündung).
Infektionskrankheiten bei einer aplastischen Anämie treten häufiger und mit einem schwereren Verlauf auf, als dies bei nicht betroffenen Menschen im Allgemeinen der Fall ist. Werden Symptome wie Fieber und Schmerzen nicht rechtzeitig erkannt oder übergangen, kann es zu lebensbedrohlichen Situationen kommen.
Diagnose
Klinische Untersuchung
In den meisten Fällen führen unspezifische Beschwerden wie Schwäche, Gewichtsverlust oder Fieber den Patienten in die Arztpraxis. Kann der Erkrankte weiter über typische Anämiezeichen berichten, wird der Arzt eine eingehende Untersuchung anschließen. Blutungszeichen, eine gelbe Farbe der Haut und der Augen (Gelbsucht/Ikterus) sowie Störungen der Pigmentierung können das Bild ergänzen. Veränderungen und Deformationen des Skeletts oder ein auffälliger Kleinwuchs sind gerade bei Kindern ein wichtiger Anhalt auf eine zugleich bestehende aplastische Anämie.
Kommt der Arzt zu der Annahme einer Funktionsstörung des Knochenmarks, wird er die Einweisung in eine Spezialklinik einleiten.
Labordiagnostik
Untersuchung des Blutes (Blutbild)
Der Arzt wird die Durchführung eines Blutbildes anfordern. Moderne Verfahren ermöglichen innerhalb kurzer Zeit ein Messergebnis aller drei Zelllinien. Im sogenannten Differenzialblutbild werden die unterschiedlichen Formen der weißen Blutkörperchen ausgezählt. Bei Auffälligkeiten wird ein Blutausstrich angefertigt und von einem erfahrenen Mitarbeiter unter dem Mikroskop begutachtet.
Verminderung der roten Blutkörperchen (Erythrozytopenie): Die Anzahl der roten Blutkörperchen ist bei der aplastischen Anämie regelmäßig zu niedrig. Deren Vorstufen, die Retikulozyten, sind ebenfalls absolut in geringerer Anzahl anzutreffen. Form und Größe der Erythrozyten können ebenso einen wichtigen Anhalt bieten.
Verminderung der Blutplättchen (Thrombozytopenie): Regelmäßig kann bei der aplastischen Anämie mit einer verminderten Anzahl von Blutplättchen (Thrombozyten) gerechnet werden. Diese Thrombozytopenie bleibt selbst nach Besserung der Krankheitszeichen lange bestehen. Dies erklärt auch die bei der aplastischen Anämie häufigen Blutungen. Neben der Anzahl der Blutplättchen, deren Form und Größe spielt die Bestimmung von Gerinnungswerten wie des Quick-Wertes, der PTT (partiellen Thromboplastinzeit) und des Fibrinogens eine gewisse Rolle.
Verminderung der weißen Blutkörperchen (Leukozytopenie): Zum Bild einer aplastischen Anämie gehört ebenso eine erniedrigte Anzahl der weißen Blutkörperchen (Leukozyten). Hier ist ein besonderes Augenmerk auf die Zellart der Granulozyten zu richten. Diese Fraktion der Leukozyten kann auch dann eindeutig vermindert sein, wenn sich die Gesamtzahl der weißen Blutkörperchen noch im Normbereich befindet. Eine Verminderung der Granulozyten ist maßgeblich für Infektionen durch Pilze und Bakterien begünstigend. Der Mangel an Leukozyten wird meist erst im fortgeschrittenen Krankheitsstadium diagnostiziert.
Diagnostik von Entzündungen (Infektionsserologie): Die Entzündungsparameter (C-reaktives Protein und die Blutsenkungsgeschwindigkeit) sind typischerweise infolge auftretender Infektionen erhöht. Vielfach kann der Auslöser einer Infektionskrankheit im Blut ermittelt werden. Von Bedeutung ist die Bestimmung von Hepatitis-Viren (Erreger einer Leberentzündung) sowie der Nachweis von Antikörpern gegen Parvovirus B19 (Erreger von Ringelröteln).
Weitere Untersuchung im Blut: Bei einer geplanten Stammzelltransplantation ist unbedingt die Verträglichkeit der Gewebe von Spender und Empfänger sicherzustellen. Hierzu wird eine Typisierung der sogenannten humanen Leukozytenmerkmale (HLA) durchgeführt. Bei Verdacht auf eine Telomeropathie bieten spezielle Labors die Möglichkeit einer Messung der Telomer-Längen an. Diese Diagnostik ist bei Familienangehörigen verpflichtend, welche als Stammzellenspender infrage kommen.
Diagnostik des Knochenmarks
Zur Sicherung der Diagnose einer aplastischen Anämie muss grundsätzlich Knochenmark entnommen werden. Die Entnahme wird mittels einer Nadel (Punktion) oder einer Stanze aus dem Beckenkamm durchgeführt und ist für den Patienten ungefährlich. Allerdings birgt sie einige diagnostische Unsicherheiten. Da die Konsequenzen der möglichen Diagnose aplastische Anämie einschneidend sind, werden zwei Punktionen an unterschiedlichen Stellen vorgenommen. Optimalerweise werden diese unabhängig voneinander von unterschiedlichen Ärzten begutachtet. Die Entnahme einer kleinen Probe des Beckenknochens (Knochenmarksbiopsie) kann diagnostisch eine zusätzliche Sicherheit bieten.
Mikroskopische Untersuchung: Der Ausstrich des Knochenmarks ist durch eine deutliche Verminderung beziehungsweise das Fehlen der blutbildenden Marksubstanz charakterisiert. Stattdessen findet sich ein sogenanntes Fettmark. Dieses mikroskopische Bild nennt sich „leeres Knochenmark“ und ist nicht mit dem Begriff des „trockenen Knochenmarks“ (punctio sicca) zu verwechseln. Beim letzteren konnte durch die Punktion kein Probenmaterial gewonnen werden.
Genetische Mutationsanalyse (Chromosomenanalyse): Zur weiteren Gewährleistung der Diagnose und Abgrenzung von anderen Erkrankungen wie dem myelodysplastischen Syndrom und Leukämien werden molekulargenetische Untersuchungen herangezogen. Dabei können relevante Veränderungen an den Chromosomen in den Zellen des Knochenmarks festgestellt werden. Sind keine Veränderungen am Erbgut festzustellen, ist von einer erworbenen aplastischen Anämie auszugehen.
Bildgebung
Bildgebende Verfahren (Röntgen, Ultraschall) kommen vor allem zur Diagnostik von Begleiterkrankungen (Lungenentzündung, Leberentzündung) zum Tragen. Theoretisch ist ein erhöhter Anteil an Fettmark im Knochen auch mittels Magnetresonanztomografie (MRT) nachweisbar.
Klassifikation
Die Behandlung der aplastischen Anämie ist im Wesentlichen vom Schweregrad der Erkrankung abhängig. Dies lässt die Einteilung der aplastischen Anämie anhand unterschiedlicher Kriterien sinnvoll erscheinen. Die Basis bildet die Bestimmung der Anzahl der beteiligten Zelllinien im Blut:
- Die neutrophilen Granulozyten machen den Großteil der weißen Blutkörperchen (Leukozyten) aus. Ist deren Funktion gestört oder die Anzahl vermindert, ist eine ausreichende Immunabwehr nicht gegeben.
- Die Blutplättchen (Thrombozyten) spielen eine wichtige Rolle bei der Gerinnung, indem sie eine Verletzung verschließen können.
- Als Retikulozyten werden unreife Erythrozyten (rote Blutkörperchen) bezeichnet.
Durchgesetzt hat sich eine Klassifikation, bei der die Anzahl der oben genannten Zellen die Grundlage bildet. Für eine eindeutige Zuordnung müssen zwei der drei aufgeführten Kriterien erfüllt sein.
| Zelllinie | Referenzwerte | mäßig schwere aplastische Anämie | schwere aplastische Anämie | sehr schwere aplastische Anämie |
|---|---|---|---|---|
| Neutrophile Granulozyten | 3.000 - 6.000 | <1.000 Zellen pro µl Blut | <500 Zellen pro µl Blut | <200 Zellen pro µl Blut |
| Thrombozyten | 150.000 - 400.000 Zellen pro µl Blut | <50.000 Zellen pro µl Blut | <20.000 Zellen pro µl Blut | <20.000 Zellen pro µl Blut |
| Retikulozyten | 30.000 - 70.000 Zellen pro µl Blut | <60.000 Zellen pro µl Blut | <20.000 Zellen pro µl Blut | <20.000 Zellen pro µl Blut |
*) Referenzwerte sind abhängig vom Alter und Geschlecht des Patienten. Die in der Tabelle angegebenen Werte dienen lediglich der groben Orientierung.
Differenzialdiagnose
Hinter der niedrigen Anzahl der verschiedenen Zellen des Blutes können diverse andere Krankheiten stecken.
- Verminderte Zellzahlen, ob bei einer einzelnen Zelllinie oder einer Panzytopenie (erniedrigte rote und weiße Blutkörperchen und Blutplättchen) sind auch bei akuten Leukämien anzutreffen.
- Aufgrund der niedrigen Thrombozytenzahl kann die aplastische Anämie mit der idiopatisch thrombozytopenischen Purpura verwechselt werden. Hier sind Antikörper gegen die Blutplättchen nachweisbar, welche diese zerstören. Eine klare Abgrenzung der aplastischen Anämie zu diesem Krankheitsbild ist gegeben, wenn darüber hinaus die neutrophilen Granulozyten und die Retikulozyten erniedrigt sind.
- Ebenso ist an Karzinome zu denken, welche Metastasen (Tochtergeschwülste) in den Knochen gebildet haben.
- Ist die Milz krankhaft vergrößert, kann es zum vermehrten Abbau aller drei Zelllinien kommen. Dies macht sich im Labor ebenfalls durch eine reduzierte Anzahl aller Blutzelllinien bemerkbar.
Wie die Beispiele aufzeigen, ist eine genaue Diagnostik in jedem Fall notwendig. Dazu gehören eine Begutachtung der Blutzellen nach Größe und Form ebenso wie die Suche nach Antikörpern gegen körpereigene Zellen (Autoimmunantikörpern). Genetische Untersuchungsmethoden sind von hoher Wichtigkeit, um beispielsweise eine Fanconi-Anämie oder eine Telomeropathie festzustellen.
Während Infektionen die Folge von Knochenmarksveränderungen sein können, kann es umgekehrt auch zu Veränderungen des Knochenmarks durch entzündliche und infektiöse Erkrankungen kommen. Bei diesen reaktiven Veränderungen des Knochenmarks spielen bestimmte Eiweiße (Zytokine) eine bedeutende Rolle, sie sind dann im Labor vermehrt nachzuweisen. Hierbei wird das natürliche Gleichgewicht, unter anderem des Eisenstoffwechsels, im Organismus gestört, was zu einer Schädigung des Knochenmarks führt.
Therapie
Der größte Anteil der aplastischen Anämien wird durch Substanzen hervorgerufen, welche für das Knochenmark gesundheitsschädliche Auswirkungen haben. Daraus ergibt sich die zwingende Notwendigkeit, diese Auslöser zu finden und zu entfernen.
Die Therapie stützt sich auf den Schweregrad der aplastischen Anämie anhand der beschriebenen Klassifizierung. Bei der Wahl der Therapie sind zusätzlich das Alter des Patienten sowie bei einer angedachten Stammzelltransplantation die Voraussetzungen hinsichtlich eines Spenders von Bedeutung.
Die nicht schwere aplastische Anämie bedarf häufig keiner besonderen Therapie. Solange der Patient in diesem Stadium verbleibt, sind regelmäßige Kontrolluntersuchungen die einzige Maßnahme.
Dringlich ist eine Therapie immer bei einer schweren oder sehr schweren aplastischen Anämie.
Anzeichen, welche für den Übergang einer nicht schweren in eine schwere aplastische Anämie sprechen, bedürfen ebenfalls dem sofortigen Beginn einer Behandlung. Diese sind wie folgt:
- die Verminderung der Zellzahl weiterer Zelllinien
- ein regelmäßiger Bedarf an Blutkonserven (Erythrozytenkonzentraten)
- das verstärkte Auftreten von Infektionen
- ungewöhnliche Blutungen
Beim Bestehen einer schweren aplastischen Anämie ist von einer eigenständigen Verbesserung oder Heilung nicht auszugehen. Der Arzt kann in diesen Fällen auf unterschiedliche Behandlungsmethoden zurückgreifen.
Stammzelltransplantation
Bei einer Stammzelltransplantation werden die kranken blutbildenden Zellen des Patienten durch gesunde Stammzellen ersetzt. Um eine erfolgreiche Transplantation des fremden Gewebes zu gewährleisten, müssen zuvor alle blutbildenden Zellen des Empfängers zerstört werden. Dieses Verfahren wird Konditionierung genannt. Meist wird eine Kombination aus zellwachstumshemmenden Substanzen (Zytostatika) und sogenannten monoklonalen Antikörpern (Alemtuzumab) verwendet. Letzteres soll genauso wie das Anti-Thymozyten-Globulin (ATG) Blutzellen und deren Vorläufer im Knochenmark und im Blutkreislauf zerstören.
Diese Darstellung lässt schon vermuten, dass es sich bei der Konditionierung um einen äußerst kritischen Moment im Rahmen der Stammzelltransplantation handelt. Während dieser Phase besitzt der Organismus des Patienten praktisch kein funktionierendes Immunsystem mehr. Um jedem Infektionsrisiko vorzubeugen, sind die Erkrankten während der Behandlung in einem keimfreien Zelt (Life-Island) untergebracht.
Für die eigentliche Transplantation ist eine Übereinstimmung von Spender und Empfängergewebe eine wesentliche Voraussetzung. Dies wird durch die Bestimmung der HLA-Gewebeverträglichkeit überprüft. Spender können vor allem Verwandte, insbesondere Geschwister sein. Auch fremde Personen mit entsprechendem Muster in der Gewebeübereinstimmung kommen infrage. Allerdings ist die Übertragung von Stammzellen fremder Menschen mit einem hohen Risiko verbunden und wird daher nur als letztes Mittel erwogen.
Vorstufen der blutbildenden Zellen (Stammzellen) können sowohl aus dem Blutkreislauf als auch aus dem Knochenmark gewonnen werden. Bei der aplastischen Anämie wird vorwiegend die Transplantation von Stammzellen aus dem Knochenmark empfohlen. Somit kann das Risiko einer Graft-versus-Host-Reaktion (GvHR) reduziert und die Überlebensrate erhöht werden. Bei der GvHR handelt es sich um eine lebensbedrohliche Reaktion des Empfängerorganismus auf Spenderzellen.
Vor allem Kinder profitieren mit einer 90-prozentigen Heilungschance von der Stammzellübertragung. Bei entsprechenden Voraussetzungen ist sie auch bei Erwachsenen bis zu einem Alter von 40 Jahren die einzige aussichtsreiche Therapieform, welche zur einer Heilung führen kann.
Immunsuppressive Therapie
Nicht immer sind die Voraussetzungen für eine Stammzelltransplantation gegeben. In diesen Fällen ist das oberste Ziel, die akute und vielfach lebensbedrohliche Situation einer aplastischen Anämie zu beseitigen. Langfristig wird angestrebt, ein Leben möglichst frei von Beschwerden zu erreichen. Auch wenn eine Heilung nicht gegeben ist, kann der Verbleib in einer für den Patienten erträglichen Phase der Erkrankung (Remission) erwirkt werden.
Die aktuell wirksamste Methode besteht in der Behandlung mit Immunsuppressiva (immununterdrückenden Medikamenten). Nach aktuellem Wissen greift bei der aplastischen Anämie das körpereigene Immunsystem die blutbildenden Stammzellen im Knochenmark an. Bei der immunsuppressiven Therapie sollen die Mechanismen, welche daran beteiligt sind, unterdrückt werden. Gesunde Stammzellen werden neu gebildet und können sich zu ausgereiften Blutzellen entwickeln.
Bewährt hat sich eine Kombinationstherapie, bei der ein Zytostatikum (Mittel, das Zellen wie die beteiligten Immunzellen hemmt) gemeinsam mit Anti-Thymozyten-Globulin (ATG) verabreicht wird. Die Patienten müssen sich im Klaren sein, dass eine langjährige Therapie notwendig werden kann. Dies beinhaltet auch, dass mit beträchtlichen Nebenwirkungen zu rechnen ist. Medikamente, welche das Immunsystem unterdrücken, sind bisher kaum in der Lage, gezielt einen einzelnen Mechanismus auszuschalten. So werden meist auch Zellen in Mitleidenschaft gezogen, die beispielsweise der Abwehr von Infektionskrankheiten dienen. Es liegt nun an den behandelnden Ärzten, das Risiko gegen einen möglichen Vorteil der Behandlung abzuschätzen.
Die Behandlung wird in den ersten Tagen stationär in einem spezialisierten Klinikum durchgeführt. Daran anschließend bekommt meist die weitere Medikamentengabe in Tablettenform den Vorzug.
Der Behandlungserfolg ist individuell unterschiedlich. Er hängt stark von der Schwere der Erkrankung, des Alters und dem Allgemeinzustand sowie Begleiterkrankungen ab. Es wird davon ausgegangen, dass nach einer Behandlungsdauer von drei bis sechs Monaten ein deutlicher Anstieg der Zellzahlen im Blut und Knochenmark erfolgen sollte.
Aufgrund einer Vielzahl möglicher Folgeerkrankungen und Komplikationen sowie einer nicht unerheblichen Rückfallquote ist eine engmaschige Kontrolle zwingend. Jegliche Beobachtung einer vermehrten Infektionsanfälligkeit oder Blutungsneigung muss einen Arztbesuch nach sich ziehen.
Stimulierung der Blutbildung (Myelostimulatorische Therapie)
Eine neuere Methode der Therapie der aplastischen Anämie ist die Anwendung von anabolen Steroiden. Vor allem Testosteron und die künstlich hergestellte, verwandte Substanz Oxymetholon zeigen positive Effekte auf die Stimulierung blutbildender Stammzellen. Die Stimulation bezieht sich bisher ausschließlich auf die Neubildung der Vorläufer roter Blutkörperchen. Hier muss ebenfalls mit einer langen Zeitspanne bis zum Wirkeintritt gerechnet werden (ein bis drei Monate). Bis zu 50 Prozent aller behandelten Patienten können bei dieser Therapie einen langanhaltenden Rückgang der Symptomatik erreichen. Dieser Nutzen ist jedoch meist mit einer dauerhaften Behandlung und den daraus resultierenden negativen Begleiterscheinungen verbunden. An möglichen Nebenwirkungen sind vor allem Funktionsstörungen der Leber sowie bei weiblichen Patienten eine zunehmende Vermännlichung hervorzuheben.
Weitere Behandlungsmethoden
Die Therapie der aplastischen Anämie kann nicht einem einheitlichen Schema folgen. So wird bei der Gabe eines sogenannten monoklonalen Antikörpers allgemein über eine vergleichsweise geringe Ansprechrate berichtet, während dasselbe Medikament bei der Behandlung wieder aufflammender Symptome nach einer Erstbehandlung Ansprechraten bis zu 50 Prozent aufweisen kann.
Supportive Therapie
Unter einer supportiven Therapie werden unterstützende Maßnahmen verstanden. Bei der aplastischen Anämie ist in den meisten Fällen erst nach einer längeren Behandlungsdauer mit einer Besserung zu rechnen. Während dieser Zeit wird versucht, die vielfach lebensbedrohlichen Symptome in ihrem Ausmaß zu beschränken. Somit ist die unterstützende Therapie in besonderem Maße wichtig für das Überleben der Patienten in der ersten Phase nach Diagnosestellung. Entscheidend sind eine hinreichende Vorsorge gegenüber Infektionskrankheiten sowie die sorgfältig überdachte Gabe von Blutkonserven.
Infektionsvorsorge
Die aplastische Anämie geht mit einem hohen Risiko an ansteckenden Krankheiten einher. Fieber, auch ein geringes Ansteigen der Temperatur, ist als unbedingtes Anzeichen einer Infektion zu werten. Darüber hinaus müssen sich Patienten mit einer bekannten aplastischen Anämie bereits beim Erscheinen banaler Infektionen rasch und gezielt behandeln lassen. Bakterien und Pilze können effizient durch die Gabe von Antibiotika beziehungsweise Antimykotika (Mittel gegen Pilze) bekämpft werden. Hier kann das Mitführen eines Antibiotikums mit breitem Wirkspektrum hilfreich sein („Pill in the Pocket“). Infektionskrankheiten, welche durch Viren oder Parasiten verursacht werden, ist am besten durch eine Meidung entsprechender Gefahrenherde zu begegnen.
Impfungen sind mit großer Sorgfalt abzuwägen. Die Wirkung einer Impfung besteht in einem vorsichtigen Heranführen des Immunsystems an mögliche Krankheitserreger. Da das Immunsystem bei einer aplastischen Anämie in seiner Wirkung stark beeinträchtigt ist, können Impfungen, vor allem mit Lebendimpfstoffen, zu einer schweren Krankheitskrise führen. Dennoch empfehlen verschiedene Quellen eine Impfung gegen Meningokokken (Bakterien, die eine Gehirnhautentzündung verursachen).
Blutungsprophylaxe
Bei einer Verminderung der Thrombozyten (Thrombozytopenie) ist die Gerinnung gestört, was eine Blutungsneigung zur Folge hat. Verschiedene Medikamente, vorneweg sogenannte Thrombozytenaggregationshemmer (Acetylsalicylsäure, ASS), müssen von den Patienten strikt vermieden werden. Diese können zu vermehrten und bisweilen lebensbedrohlichen Blutungen führen.
Bei Frauen in gebärfähigem Alter ist die Verhinderung starker und lang anhaltender Regelblutungen zu überdenken. Die Einnahme von Ovulationshemmern (Mitteln, die den Eisprung unterdrücken) wird in jedem Fall empfohlen. Bei einer ausgeprägten Monatsblutung kann eine Verödung der Gebärmutterschleimhaut (Menolyse) angedacht werden.
Ersatz von Blutbestandteilen
Der Einsatz von Blutkonserven kann nur eine vorübergehende Maßnahme zur Behandlung verminderter roter Blutkörperchen (Erythrozyten) sein. Eine langfristige Gabe wird möglicherweise schwere Komplikationen, insbesondere eine Eisenüberladung, zur Folge haben. Vielfach haben sich die Patienten im Verlauf der Erkrankung an den Mangel an roten Blutkörperchen angepasst. Blutkonserven können erst bei einem Hämoglobinwert von unter 8 mg/dl notwendig werden (der Hämoglobinwert ermöglicht Rückschlüsse auf die Versorgung mit Sauerstoff).
Wird eine erhöhte Blutungsgefahr festgestellt, kommt die Übertragung von Thrombozyten (Blutplättchen) infrage. Thrombozytenkonserven tragen allerdings das Risiko einer allmählichen Unverträglichkeit. Durch die mögliche Bildung von Antikörpern können die gegebenen Thrombozyten vorzeitig zerstört werden.
Einsatz von Wachstumsfaktoren
Unterstützend bei einer immunsuppressiven Therapie werden vielfach Wachstumsfaktoren verabreicht. Diese können bis zum Wirkeintritt einer immunsuppressiven Therapie sowohl die Blutungsneigung als auch die Infektionsgefahr gering halten. Die Wirkung scheint vor allem bei der kombinierten Gabe von Immunsuppressiva und Wachstumsfaktoren zu einer eindeutigen Verbesserung der Symptomatik bei der aplastischen Anämie zu führen. Dennoch benötigen auch diese Wachstumsfaktoren eine gewisse Zeit bis zum Ansprechen. Bei Granulozyten stimulierenden Faktoren (G-CSF) rechnet man mit durchschnittlich vier Wochen. Etwa die Hälfte aller behandelten Patienten profitiert dabei von einer eindeutigen Herabsetzung der Infektionsgefahr. Bei den Wachstumsfaktoren, welche das Wachstum der Blutplättchen stimulieren (Eltrombopag), ist bisweilen erst nach einem halben Jahr mit einem Erfolg zu rechnen. Im Hinblick auf eine hohe Ansprechrate von beinahe 80 Prozent kann diese Medikation dennoch sinnvoll erscheinen.
Chelattherapie
Eine große Anzahl von Blutkonserven lassen den Ferritinspiegel im Blut bisweilen stark ansteigen. Ferritin ist ein Eiweiß, in dem Eisen gespeichert wird, und ein erhöhter Wert ist somit ein Anhaltspunkt für eine Überladung des Organismus mit Eisen. Das Metall lagert sich in Organen ab und führt dort zu krankhaften Veränderungen. Dies begründet bei einer langanhaltenden Therapie mit Blutkonserven die Gabe von Eisenchelatoren. Solche sogenannten Chelatbildner sind in der Lage, Metalle zu binden und sie aus dem Körper auszuschleusen.
Eine Überladung mit Eisen kann bei einer geplanten allogenen (von einem anderen Spender kommenden) Stammzelltransplantation zu Komplikationen führen. Der Behandlung mit Chelatbildnern kommt folglich auch hier eine große Bedeutung zu.
Splenektomie
In ausgewählten Fällen kann die Entfernung der Milz (Splenektomie) zu einer Verbesserung der Symptome bei der aplastischen Anämie führen. Die Milz ist für den Abbau von Blutzellen nach einem gewissen Zeitraum verantwortlich. Kann sie ihrer Aufgabe nicht mehr nachkommen, verlängert dies die Lebenszeit der vorhandenen Zellen und kann zu einem Anstieg der Zellzahlen führen.
Komplikationen
Die Schwere der Erkrankung erfordert Behandlungsmaßnahmen, welche ein hohes Maß an Komplikationen mit sich bringt. Der Arzt muss im jedem einzelnen Fall entscheiden, ob eine Therapie eher Nutzen bringt oder die wahrscheinlichen Nebenwirkungen dem Patienten eine mindere Lebensqualität oder weitere Risiken verschafft.
Ein wesentlicher Faktor ist hierbei die statistische Überlebenswahrscheinlichkeit. Für den betroffenen Patienten mag dies unpersönlich klingen, ist jedoch für die Strategie einer zielführenden Therapie von großer Bedeutung.
Die häufigste Fragestellung in diesem Zusammenhang bezieht sich auf das Risiko einer Krebserkrankung. Verschiedene Studien gehen von einer bis Faktor 5 erhöhten Wahrscheinlichkeit von Krebs aufgrund der Therapie aus. Dies trifft sowohl Patienten, die sich einer immunsuppressiven Therapie unterzogen, als auch Patienten nach einer Knochenmarkstransplantation.
Infektionen im Rahmen einer Stammzelltransplantation gehören zu den größten Risikofaktoren. Die Sterblichkeitsrate aufgrund von Infektionen wie auch aufgrund transplantationsbedingter Komplikationen ist hingegen in den letzten Jahren deutlich zurückgegangen.
Einschneidend, aber nicht unbedingt mit einer erhöhten Rate an Todesfällen kann die Behandlung mit anabolen Steroiden bezeichnet werden. Die Einnahme von Testosteron über viele Jahre führt zu einer Vermännlichung, was gesundheitliche Nebenwirkungen wie die Veränderung der äußeren Genitalien, eine tiefe Stimme oder Gewichtszunahme nach sich zieht.
Prognose
Ohne eine rechtzeitige Therapie führt die aplastische Anämie in drei Viertel aller Fälle zum frühzeitigen Tod des Patienten. Dagegen steht eine mit 90 Prozent hohe Aussicht auf Heilung bei Kindern, welche mit einer Stammzelltransplantation behandelt wurden.
Eine Immunsuppressive Therapie geht mit einer erhöhten Rückfallquote einher. Diese Patienten entwickeln in den folgenden Jahren zudem häufig Erkrankungen wie ein myelodysplastisches Syndrom oder Leukämien. Dennoch kann etwa die Hälfte der Behandelten über einen langen Zeitraum normal am Leben teilhaben.
Grundsätzlich wird von einer besseren Prognose bei Kindern als bei Erwachsenen ausgegangen.
Eine Studie aus dem Jahr 2015 zeigt einen Zusammenhang der Prognose der aplastischen Anämie mit bestimmten Veränderungen (Mutationen) im Knochenmark. So gibt es den Wissenschaftlern zufolge Mutationen, welche ein besseres Ansprechen auf eine Therapie vorhersagen lassen. Andere Veränderungen des Erbgutes können auf eine mögliche Entwicklung der aplastischen Anämie hin zu einer Leukämie hinweisen.
Die Sprechweise der Studie, es handele sich um „gewisse Aussagen“, zeigt, dass es noch großer wissenschaftlicher Anstrengung bedarf, die Ursachen und Therapiemöglichkeiten zu erforschen.
Aktuell bleibt die Empfehlung, möglichst viele Patienten in Studien einzuschließen und die Erkenntnis dem europäischen Register der Arbeitsgruppe Aplastische Anämie der EBMT (European Bone and Marrow Transplantation Group) zuzuführen.
Links und weiterführende Informationen
- APLASTISCHE ANÄMIE & PNH E.V. - Informationen zur Aplastischen Anämie
- Deutsche Leukämie- & Lymphom-Hilfe e.V. (DLH)
- Lichterzellen, Stiftung zur Hilfe bei PNH/AA
- ACHSE e.V. - Allianz Chronischer Seltener Erkrankungen
- Buchtipp: Ich liebe das Leben viel zu sehr
Wie ich gegen den Tod rebellierte und eine zweite Chance bekam
Sonja Finck, Mathias Malzieu
Verlag: carl's books; Auflage: Deutsche Erstausgabe (9. Oktober 2017)
Quellen anzeigenQuellen ausblenden
Quellen
Onkopedia: https://www.onkopedia.com/de/onkopedia/guidelines/aplastische-anaemie/@@view/html/index.html (online, letzter Abruf: 19.08.2019)
Informationsportal Blut- und Gerinnungserkrankungen bei Kindern: https://www.kinderblutkrankheiten.de/content/erkrankungen/blutbildungsstoerungen/aplastische_anaemie/ (online, letzter Abruf: 19.08.2019)
Amboss: https://www.amboss.com/de/wissen/aplastische_an%C3%A4mie (online, letzter Abruf: 19.08.2019)
aktualisiert am 22.02.2022




